
黄少隆,张翠惠,黄冬枚,郭文婷,郑庆茹
(东莞市滨海湾中心医院检验科,广东 东莞 523903)
摘 要:【目的】探究山豆根对金黄色葡萄球菌毒力表达的影响,为临床用药提供进一步实验数据,丰富山豆根抗菌药用价值参考资料。【方法】分别采用紫外吸光度法,扫描电镜,溶血试验法和Western Blot检测了山豆根作用后金黄色葡萄球菌胞膜通透性,菌体形态变化,溶血活性和外毒素的表达。【结果】高浓度的山豆根可抑制金黄色葡萄球菌生长,但效果较差,亚抑菌浓度下能破坏胞膜完整性,降低溶血能力和α-溶血素、SEA和SEB分泌。【结论】山豆根对金葡菌相关毒力的表达有抑制作用,具有重大研究价值。
关键词:山豆根;金黄色葡萄球菌;毒力表达
Inhibiton of Sophora tonkinensis Gagnep on expression of virulence of
Staphylococcus aureus
HUANG Shaolong,ZHANG cuihui, HUANG dongmei,GUO Wengting ,ZHEN Qingru
(Binhaiwan Central Hospital of Dongguan, Dongguang,Guangdong 523903, China)
Abstract: 【 Objective 】 To explore the effect of Sophora tonkinensis Gagnep on the expression of virulence of Staphylococcus aureus, and to provide further experimental data for clinical drug use, so as to enrich the reference materials of medicinal antimicrobial value of Sophora tonkinensis Gagnep.【 Methods 】 Ultraviolet absorbance, scanning electron microscopy, hemolysis assay and Western Blot were used to detect the membrane permeability, morphological changes, hemolytic activity and exotoxin expression of Staphylococcus aureus.【 Results 】 The growth of S. aureus was inhibited by high concentration of Sophora tonkinensis Gagnep, but the effect was poor. The integrity of cell membrane, hemolytic ability and secretion of α-hemolysin, SEA and SEB were damaged at subinhibitory concentration.【 Conclusion 】Sophora tonkinensis Gagnep can inhibit the expression of S. aureus related virulence, which has great value to research.
Key words: Sophora tonkinensis Gagnep;Staphylococcus aureus;Virulence express
* 【基金项目】东莞市科学技术局(NO:202050715025009)
金黄色葡萄球菌在自然界中广泛存在,其对生长环境要求低,环境耐受性强[1],能够产生溶血素、肠毒素、血浆凝固酶、毒性休克综合征毒素等[2,3]等多种毒力因子,临床上常引起化脓性疾病、呕吐、腹泻、肠炎和毒素性休克等,严重时则导致全身性败血症[4,5]给人类健康带来严重的安全隐患。然而由于抗生素的滥用,金黄色葡萄球菌耐药形势越来越严峻,近些年甚至出现万古霉素敏感性下降的耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)菌株[6,7],显然传统抗生素已经难以面对挑战,这迫使我们必须积极寻求新型抗菌药。毒力因子的表达决定着金黄色葡萄球菌致病性的强弱[8],因此抑制和降低毒力因子的表达是当前研究的热点具有重大意义。
山豆根是一味运用历史悠久的中药材,属于双子叶植物纲豆科植物,是越南槐的干燥根及根茎[9],中药辞典记载,山豆根性寒,味苦,归肺、胃经,有清热解毒、消肿止痛、抗菌消炎等疗效[10]。胡庭俊等研究发现山豆根醇提取物、多糖具有抗氧化及抑菌作用[11]。但是,迄今为止,尚未见山豆根对金黄色葡萄球菌毒力表达的有关研究。本实验拟测定对金葡菌的最低抑菌浓度(MinimalInhibitoryConcentration,MIC),胞膜通透性,菌体形态变化,溶血活性和外毒素的影响,以期为金黄色葡萄球菌控制和临床上山豆根抗菌运提供 试验依据。
材料与方法
1 材料与仪器
山豆根(重庆三立堂中药制药有限公司);金黄色葡萄球菌ATCC29213来自广东省临检中心;MRSA分离于临床病人标本;β-半乳糖苷酶(Solarbio);脱纤维兔血(Solarbio);扫描电镜(Phenom G6 pure );分光光度计(菲勒D-7);电泳仪(1645050型,美国Bio-Rad公司);冷冻离心机(Microfuge5804R型,德国Eppendorf公司);实时荧光定量PCR仪(iQ5型,美国Bio-Rad公司);酶标仪(680型,美国Bio-Rad公司);超微量核酸分析仪(Nano-200型,杭州奥盛仪器有限公司);Tanon 5200 全自动化学发光图像分析系统。
2方法
2.1 山豆根 取山豆根药材粗粉过40目筛,精密称量约1.5 g置索氏提取器中,滴加无水乙醇-浓氨试液(3∶2)混合溶液2 ml使湿润,放置30 min后,加三氯甲烷80 ml,加热回流提取4 h,提取液回收三氯甲烷并浓缩至干,残渣用甲醇溶解并转移至1 ml容量瓶中,加甲醇至刻度,摇匀,滤过,即得1.5g提纯药粉,后续用于实验。
2.2 山豆根对金葡菌MIC及生长曲线测定 实验根据CLSI推荐的标准方法来测定山豆根对金葡菌的MIC.将金葡菌在紫外分光光度计下进行调菌,使得OD600=0.4。量取上述提取1.5 g的山豆根药粉装入1.5mL离心管中,将1.5g/ml溶液稀释至0.96g/ml,后续再二倍稀释。通过计算得出20mL的体积下山豆根的加入量,使溶液最终浓度调整为0g/mL、0.015g/mL、0.03g/mL、0.06g/mL。设置不同的时间点分别为1h,2h,3h,4h,5h,6h,7h,8h,9h,10h,11h,12h时间段连续测600nm处吸光度值。每个时间点测完之后将锥形瓶放入摇床中继续生长。
2.3 金葡菌内膜通透性实验 调菌OD600=0.4,配制山豆根溶液最终浓为0g/mL、0.015g/mL、0.03g/mL、0.06g/mL。设置在不同的时间点分别为0h,1h,2h,4h,6h,8h处,将锥形瓶从摇床中取出20ml金葡菌,打开离心机进行离心(4℃,5000g,10min)后,此次吸取上清液,弃掉沉淀,往盛有金葡菌的离心管中加入浓度为0.05moL/L的ONPG进行底物反应,该实验过程在水浴锅中进行,调整好温度和时间为37℃,40min。之后加入终止液0.5moL/L Na2CO35mL使反应结束。将金葡菌与反应液和终止液在涡旋振荡仪上进行充分溶解,用紫外分光光度计测定在420nm处的吸光值。
2.4 扫描电镜实验实验 选取 1cm 玻片进行冰醋酸处理,浸泡 3h 后再用蒸馏水多次冲洗干净;再进行无水乙醇处理,浸泡 3h 后再用蒸馏浸泡 2h,通风晾干。121℃高压灭菌 20 min 后将其烘干之后放入超净台。再使用紫外分光光度计进行调菌,使得 OD600=0.4。将已经调整好浓度的金葡菌吸出并加到 24 孔板中,其中玻片经过用多聚赖氨酸包被 10 h。在恒温培养箱中 37℃过夜培养。次日,将0.03g/ml山豆根储存液加入到菌悬液中作用不同时间点。加药处理后, PBS 缓冲液缓慢地冲洗 24 孔板底部 3 次(每次洗涤时间为 15 min),每孔加入 1 mL 戊二醛( 2.5 %)起到固定作用。 2h 后再用蒸馏水冲洗多次后使用锇酸固定 30min。之后再使用不同浓度的乙醇冲洗,浓度按加入顺序分别为50%, 70%, 80% 、 90%、 100%。其中前四种冲洗一次,每次 10min。为了冲洗的更加彻底最后一个进行冲洗 3 次,每次 10min。最后乙醇置换通过使用叔丁醇,作用时间为 10 min。然后就可以真空干燥,经过离子喷金,进行扫描电镜观察的结果分析。
2.5 山豆根对金葡菌的溶血能力的影响 配制山豆根浓度为0g/mL、0.015g/mL、0.03g/mL、0.06g/mL。然后将培养好的金葡菌取出适量进行离心(4℃,5500g,1min),离心过后取上清液将沉淀弃掉。准备1个已经灭菌后的1.5mL离心管,加入上清液100μL,溶血素缓冲液800μL,脱纤维兔血25μL后充分混合。并且实验需要设置空白对照组,取溶血素缓冲液作为该实验的对照组,将其拿到培养箱中进行37℃恒温培养30min后,将样品取出,进行离心(5500g,1min,室温),之后通过紫外分光光度计在543nm处测量吸光度值。
2.6 Western Blot 法测定山豆根作用金葡菌外毒素的表达 将金葡菌将菌悬液在600nm处的值调整为0.3,开始加山豆根,使得药物最终浓度为0g/mL、0.015g/mL、0.03g/mL、0.06g/mL,继续放入摇床中进行培养。当加有山豆根的菌悬液的OD600值为2.5时,停止培养。将事先准备好的已经灭菌的2mL的离心管中加入菌悬液,每个梯度为10个离心管,进行离心(4℃,8500g,30min),离心之后取上清加入三氯乙酸进行沉淀蛋白,并将盛有离心管的离心管家加入冰箱4℃中,进行过夜培养。次日取出离心管再次进行一样的离心操作,此次将上清液弃掉,保留沉淀。接着用冰乙醇进行反复洗涤三次,离心弃去上清液,将沉淀放在超净台里,打开通风让其快速风干。之后每个离心管中加入1μLPMSF和10μL0.1MTris缓冲液将沉淀溶解。之后将每个梯度的所有离心管都收集在一个离心管中,在-20℃保存。Western Blot实验操作流程。
结果与分析
1 山豆根对金葡菌的生长的影响 对于金葡菌标准株ATCC29213,山豆根的MIC为0.6 g/mL。对于MSRA菌株观察得到抑菌作用略差,MIC为1.3g/mL。山豆根作用下金葡菌生长曲线如图2.1直观反映了不同浓度的山豆根对金葡菌生长过程各个时间点的作用效果。
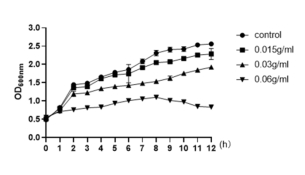
图1 不同浓度山豆根作用下金葡菌的生长曲线
2 山豆根作用不同时间点的金葡菌内膜通透性的变化 随着山豆根浓度的升高,β-半乳糖苷酶的活性也逐渐增加。
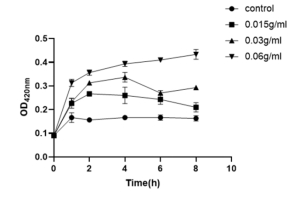
图2 山豆根作用后金葡菌悬液种β-半乳糖苷酶活力变化
3扫描电镜下细菌的形态分析 如下图所示,在0.3 g/ml山豆根刺激作用下, 0h、1.5h、 3h不同时间点,细胞形态发生着显著的变。图中的(a)为空白,金葡菌菌体呈现出正常形态,细胞表面是光滑的没有任何凹凸,表明细胞膜的结构没有受到破坏。图(b)(c),细胞均有不同程度的变化,菌体形态不再是完整的球状, 1.5h 时的细菌已破裂,发出扭曲,凹陷。但有少数菌体仍处于完整的状态,说明此作用时间下并没有引所有菌体破坏。3h 时,菌体破裂程度进一步加深,周围出现碎片,菌体数量减。因此,山豆根对金葡菌细胞壁和细胞膜都有严重影响作用时间延长,细胞受损程度也越来越严重。
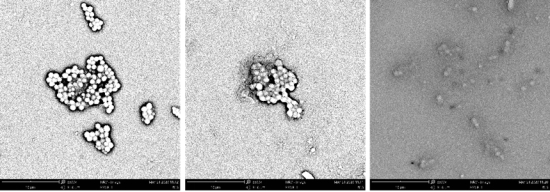
(a) (b) (c)
图3 山豆根作用金葡菌菌体(a) ControL (b) 1.5 h (c)3h 扫描电镜图
4山豆根对金葡菌溶血活力的影响 实验结果如图2.4(a)和(b),在0.015g/mL、0.03g/mL、0.06g/mL的不同浓度下,溶血能力呈逐渐下降趋势,溶液颜色逐渐由红色变成无色,溶血能力分别为67.8%、37.13%、9.11%,0.06g/mL时与空白组的9.01%相近。因此,亚抑菌浓度下的山豆根可以使得金葡菌的溶血能力大幅度下降。

(a)
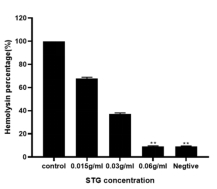
(b)
图4 金葡菌上清溶血活力的定性(a)及定量分析(b)
5 WesternBlot检测山豆根对毒力蛋白的影响 如图5,随着山豆根浓度增大,条带颜色也越来越窄,说明对这三种毒素产生量越来越少。0.06g/mL时,SEA和SEB的条带颜色几乎看不见,换言之,此浓度下可以完全抑制SEA 和 SEB的分泌。因此,亚抑菌浓度下的山豆根对金葡菌所分泌的有着显著的抑制作用,且作用效果呈剂量依赖性。
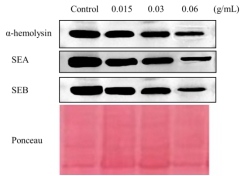
图5亚抑菌浓度的山豆根对金葡分泌的α-溶血素、SEA以及SEB蛋白的免疫印迹分析
讨论
控制细菌感染的治疗中,抗生素的使用无疑是人类手中的杀手锏,然而细菌耐药性的发展却无法通过人为干预阻止其发生。金黄色葡萄球菌在感染过程中通过群体感应系统( Quorum-sensing system) 控制表达包括α-溶血素、SEA以及SEB 在内的多种毒力因子。如果控制细菌毒力的表达同时又不对细菌生存产生选择性的压力,这可能是阻止细菌耐药发展进程的最佳手段。同时,失去致病能力之后的病原反而易于被机体的免疫系统清除[12]。因此,许多研究者把目光转向天然的中草药抑菌研究中,以期从中分离出此类抗菌抑制物。研究表明,山豆根中含有生物碱类、黄酮类、皂苷类、多糖、酚类、有机酸、微量元素等多种化学成分[13],临床上常用于治疗咽喉、牙龈肿痛,湿热黄疸以及肝炎肝癌等疾病。近年来,其在抗菌及抗病毒方面的作用的研究也备爱关注。山豆根根状茎中提取得到的苦参碱类有抗柯萨奇B3病毒和抗H3N2流感病毒的作用[14],喹诺里西啶类生物碱具有抗乙肝病毒的作用[15]。山豆根中含有的众多种生物碱也对多种细菌有抑制作用,呈现量效关系[16]。但山豆根对金葡菌抑制作用研究甚少,基于此本实从金葡菌的生长,胞膜完整性,溶血能力及外毒素的表达等方面进行研究,现分析如下。
山豆根对金黄色葡萄球的生长抑制作用较差,对于金葡菌标准株ATCC29213,山豆根的MIC为0.6 g/mL。对于MSRA菌株观察得到抑菌作用略差,MIC为1.3g/mL,比金葡菌标准株ATCC29213提高了一倍。但抑制作用依然呈浓度依赖的方式。由图2.1中观察到,随着时间增加,每个梯度金葡菌生长均有提高,但趋势却不尽相同。当山豆根浓度为0g/mL时,曲线反映的是在正常不受任何外界环境的刺激下,金葡菌在各个时间点的生长曲线始终呈现上升趋势。加了0.015g/mL山豆根作用的生长曲线略低于不加山豆根的生长曲线。在0.03g/mL的作用下,金葡菌在12h处呈现下降趋势,当在0.6 g/mL条件下,山豆根作用9h后金葡菌的生长曲线明显受到抑制,约在34%左右。
金葡菌正常的生长状态下,β-半乳糖苷酶一直是细胞膜的内部物质,不会流入外部。只有当细胞膜内膜通透性发生改变时,β-半乳糖苷酶才会通过膜渗透到悬液中,使OD值发生改变。所以,可通过检测β-半乳糖苷酶的活力来研山豆根对金葡菌细胞内膜的破坏程度。实验表明,随着山豆根浓度的增加,OD420大小也随着不断提高,且呈剂量依赖关系。三组浓度作用曲线值均明显高于空白组。在最开始0h时,每个浓度组的大小都相同均是0.090,随着时间增加,在1h时,0.06g/mL的值最大为0.306,之后是32μg/mL以及16μg/mL的值为0.234,空白组OD420最低仅为0.170。8h时,0.06g/mL、0.03g/mL、0.015g/mL、0μg/mL的值达到最高峰,分别为0.42,0.28,0.22,0.165。随着山豆根浓度的升高,β-半乳糖苷酶的活性也逐渐增加。山豆根破坏了细胞膜的完整性,浓度越高破坏力越强,细胞膜的内膜通透性增大,β-半乳糖苷酶从胞内流入胞外。
本实验利用扫描电直观的从形态上判断菌体细胞是否受到山豆根的损害。从图中可以看出,正常的金葡菌菌体呈细胞表面是光滑的没有任何凹凸,表明细胞膜的结构没有受到破坏。但是,当金葡菌菌体细胞受到山豆根的不同时间 1.5h、3h 的处理后如(b)(c)所示,细胞均受到不同程度的变化,金葡菌菌体的形态不再是完整的球状,而是发生不同程度的破损。 1.5h 作用下的细胞可以清晰地观察到细胞破裂,发出扭曲,凹陷的情况。同时也存在有些细胞处于完整的状态,说明作用时间不够并没有引起其细胞损坏。当山豆根作用于 3h 时,可以明显观察到细胞破裂程度进一步加深,周围出现碎片,细胞数量减少等现象。由此可以得出,山豆根对细菌细胞壁和细胞膜都有严重影响,金葡菌菌体形态不再是完整的球状,而是发生不同程度的破损。随着作用时间延长,细胞受损程度也越来越严重。根据以往研究报导,我们可以推断出在山豆根作用下,它可以首先作用于蛋白质,脂质等细胞外膜,在随着时间的增加,它可以穿过肽聚糖进入细胞膜,使得细胞膜发生显著的弯曲和畸形。
金葡菌的溶血素有着很强大的溶血能力,对人体的健康带来了巨大的威胁,它能够破坏人体的免疫系统,是人体免疫力降低,容易引发一系列的感染问题。还能诱导金葡菌产生细胞自噬反应,介导炎性体蛋白可能会引起一系列的炎症疾病的出现。还有研究报道称溶血素可以破坏细胞膜结构,在其表面形成多聚体跨膜运输的通道,是胞内物质如一些蛋白质、DNA、无机盐等生物分子流出细胞,引发二次感染反应。本实验主要通过测定不同浓度下的山豆根对金葡菌的溶血活力,分别从定性以及定量两个方面来加以说明。实验中可以直观的反映出在0g/mL、0.015g/mL、0.03g/mL、0.06g/mL的不同浓度下山豆根对金葡菌的溶血能力,可以观察到,随着浓度不断地增加,颜色逐渐有红色变成无色,在0.06g/mL时,颜色达到最浅接近空白组的颜色。表明随着山豆根的浓度增加,溶血能力呈逐渐下降趋势。从定量的实验结果可以分析出,在0.015g/mL、0.03g/mL、0.06g/mL的不同浓度下,溶血能力分别为67.8%、37.13%、9.11%,逐渐下降到与空白组的9.01%相近。由以上可以得出结论,亚抑菌浓度下的山豆根可以使得金葡菌的溶血能力大幅度下降。
WesternBlot从蛋白质水平分析了在0g/mL、0.015g/mL、0.03g/mL、0.06g/mL不同浓度下的山豆根对3种金葡菌毒力蛋白α-溶血素、SEA和SEB的抑制作用。我们可以发现:相比于空白组,加了山豆根的实验组随着山豆根浓度增大,条带颜色也越来越浅,表明对这三种毒素抑制作用越来越强。并且在0.06g/mL的浓度下,也就是说对其起到了抑制的作用。因而,我们可以得出结论,亚抑菌浓度下的山豆根对金葡菌所分泌的α-溶血素、SEA和SEB有着显著的抑制作用,且作用效果呈剂量依赖性。
综上所述,山豆根对金黄色葡萄球菌的生长抑制作用较差,对于MRSA菌株更是提高了一倍。但在在亚抑菌浓度下可使菌体胞膜的完整性被破坏使菌体形态发生改变,同时溶血活性下降,外毒素α-溶血素、SEA和SEB表达减少。鉴于各种毒素因子在金黄色葡萄球菌致病过程中的关键作用,山豆根具有开发为抗金黄色葡萄球菌感染药物的潜力。
【参考文献】
[1] Balasubramanian D, Harper L, Shopsin B, et al. Staphylococcus aureus pathogenesis in diverse host environments[J]. Pathog Dis, 2017, 75(1): ftx005.
[2] Tam K, Torres VJ. Staphylococcus aureus Secreted Toxins and Extracellular Enzymes[J]. Microbiol Spectr, 2019, 7(2): 10.1128/microbiolspec.
[3] Oliveira D, Borges A, Simões M. Staphylococcus aureus Toxins and Their Molecular Activity in Infectious Diseases[J]. Toxins (Basel), 2018, 10(6): 252.
[4] Chalmers SJ, Wylam ME. Methicillin-Resistant Staphylococcus aureus Infection and Treatment Options[J]. Methods Mol Biol, 2020, 2069: 229-51.
[5] Jung N, Rieg S. Essentials in the management of S. aureus bloodstream infection[J]. Infection, 2018, 46(4): 441-2.
[6] Diaz R, Afreixo V, Ramalheira E, et al. Evaluation of vancomycin MIC creep in methicillin-resistant Staphylococcus aureus infections-a systematic review and meta-analysis[J]. Clin Microbiol Infect, 2018, 24(2): 97-104.
[7] 郑旭婷, 陈佰义. 万古霉素敏感性下降的金黄色葡萄球菌的临床意义及对策[J]. 实用临床医药杂志, 2019, 23(9): 119-23.
[8] Jenul C, Horswill AR. Regulation of Staphylococcus aureus Virulence[J]. Microbiol Spectr, 2019, 7(2): 10.1128/microbiolspec.
[9] 程钱, 王金凤, 王宝丽, 等. 山豆根化学成分、生物活性及质量控制研究进展[J]. 辽宁中医药大学学报, 2017, 19(7): 119-25.
[10] 孙文学, 宁炼, 唐黎明. 山豆根保肝作用与肝毒性研究进展[J]. 中华中医药学刊, 2021: 1-8.
[11] 胡庭俊, 苏丽娟, 帅学宏, 等. 山豆根提取物的制备与体外抗菌及清除自由基作用的实验[J]. 广西畜牧兽医, 2009, 25(3): 136-8.
[12] Cin Kong, Hui-min Neoh, Sheila Nathan. Targeting Staphylococcus aureus Toxins: A Potential form of Anti-Virulence Therapy[J]. Toxins (Basel), 2016, 8(3): 72.
[13] 郑丽娜, 孙虎, 谢元璋, 等. 山豆根化学成分与功效、毒性相互关系的研究进展[J]. 食品与药品, 2011, 13(5): 205.
[14] 潘其明. 山豆根化学成分及生物活性的研究[D]. 广西师范大学, 2016.
[15] 徐锦龙, 段宝忠, 马卫成. 基于数据分析苦参碱对肝脏的作用[J].浙江中西医结合杂志,2019,29(1):79-81.
[16] 李维新. 管萼山豆根中生物碱的制备及其活性研究[D]. 吉首大学, 2020.

