
王立新1,张小军1,史星雲1,高 华1,2*,赵政阳1,2
(1西北农林科技大学园艺学院,陕西 杨凌 712100;2陕西省苹果工程技术研究中心,陕西 杨凌 712100)
摘要:为实现对苹果品种快速准确的鉴定,以40份国内外主栽苹果品种为试验材料,采用6%变性聚丙烯酰胺凝胶电泳检测与SSR荧光标记毛细管电泳检测相结合的方法构建苹果品种的SSR分子标记指纹图谱数据库。(1) 选用均匀分布在17条染色体上的144对SSR引物进行PCR扩增及电泳检测,并对PCR扩增体系与引物退火温度进行优化,筛选出35对多态性较高、谱带清晰的引物。结果表明:35对引物共检测到314个等位位点,每对SSR引物扩增出等位位点数3~15个,平均8.97个;多态性信息含量指数(PIC)变化范围为0.4553~0.8346,平均为0.6920;各个位点的杂合度在0.4750~1.0000之间,平均为0.7943;标记系数(MI)平均为6.2080,其中CH04c10引物对苹果基因组DNA变异检测最有效,其多态性信息含量指数和标记指数均最高,分别为0.8346和12.5190。(2) CH03d07、NZ02b1和CH05c04三对引物进行组合鉴定即可将40个苹果品种完全区分开来。(3) 荧光标记毛细管电泳检测较6%变性聚丙烯酰胺凝胶电泳检测能更加准确读出目标片段的大小,检测效果更为理想,更适合于DNA指纹图谱数据库的建立。试验结果表明:将两种方法结合构建苹果品种DNA指纹鉴定,结果更准确、更可靠。
关键词:苹果;SSR标记;荧光标记;指纹图谱
Establishment of SSR fingerprinting database on major cultivars of apple(Malus domestica)
WANG Li-xin1,Zhang Xiao-jun1,Shi Xing-yun1,Gao Hua1,2*,Zhao Zheng-yang1,2*
(1College of Horticulture,Northwest A&F University,Yangling,Shaanxi 712100,China;2Apple E&T Research Centre of Shaanxi Province,Yangling,Shaanxi 712100,China)
Abstract: In order to identify apple cultivars accurately, we established SSR fingerprinting database on 40 major cultivars of domestic and overseas apples through using the combine methods of 6% denaturing polyacrylamide gel electrophoresis detection and capillary electrophoresis detection with fluorescent SSR markers. 144 pairs of SSR primers which were chosen from 17 chromosomes were used to proceed with PCR amplification and electrophoresis. The PCR amplification system and primer annealing temperature were optimized and lastly 35 pairs of SSR primers which could amplify stable and distinct bands were screened. Results showed that the 35 pairs of SSR primers amplified a total of 314 alleles. Alleles amplified by each pair of primers ranged from 3 to 15, with a mean of 8.97. The polymorphic information content values (PIC) ranged from 0.4553 to 0.8346, with a mean of 0.6920. The heterozygosity ranged from 0.4750 to 1.0000, with a mean of 0.7943. The average of marker index (MI) is 6.2080 and the locus CH04c10 was effective to detect DNA variation . The highest value of PIC and MI was 0.8346 and 12.5190, respectively. The combination of locus CH03d07, NZ02b1and CH05c04 could identify the forty apple cultivars separately. Comparing with 6% denaturing polyacrylamide gel electrophoresis detection, the method of capillary electrophoresis detection with fluorescent SSR markers could detect target segments more accurately and ideally. It was more suitable used to establish SSR fingerprinting database. All in all, using the two methods to establish SSR fingerprinting database is accurate and reliable.
Key words:apple;SSR marker;fluorescent marker;fingerprinting
DNA指纹图谱具有多位点性、高变异性、简单而稳定的遗传性,因而自其诞生就引起了人们的重视,表现出巨大的实用价值[16]。国内外对于利用DNA指纹图谱数据库进行品种鉴定极为重视。英国、德国、荷兰、法国、西班牙等五国于1997年启动了一项利用SSR标记技术进行小麦、西红柿等主要作物品种鉴定的项目,制定了统一的利用分子标记技术进行品种鉴定的方法标准。北京农林科学院玉米研究中心已建成了基于SSR标记技术的玉米指纹图谱数据库[12],包含的玉米品种数量已达5000余份。国际植物新品种保护联盟(UPOV)已将SSR标记技术和单核苷酸多态性技术(SNP)推荐为适合构建指纹图谱数据库的两种技术,认为SSR标记技术是目前最为成熟的技术[5]。
目前建立作物的SSR指纹图谱的方法多采用琼脂糖、普通聚丙烯酰胺凝胶、变性聚丙烯酰胺凝胶电泳、TP-M13-SSR技术和常规荧光SSR技术。从分辨率上看,非变性聚丙烯酰胺凝胶均不能分辨大小在2个碱基对以内的差异,琼脂糖凝胶分辨率更低;而变性聚丙烯酰胺凝胶电泳结合放射自显影、银染等手段能够分辨最小为1个碱基对的差异,能够分辨同一SSR位点上的不同等位基因,完全满足构建指纹图谱数据库对等位基因大小分辨率的要求。基于DNA测序仪的SSR荧光标记毛细管电泳检测方法可以得到定量的DNA片段分析数据,与常规的聚丙烯酰胺凝胶电泳检测方法相比,毛细管电泳检测结果更为精确、灵敏、高效,更适用于大批量品种的检测分析[13]。因此利用变性聚丙烯酰胺凝胶电泳检测与SSR荧光标记毛细管电泳检测方法相结合的方法进行苹果品种DNA指纹鉴定,方法可行、结果可靠[3]。
苹果属种质资源丰富、种类多、分布广,且利用历史悠久,在果树栽培、生产和育种上经济价值很高[6-7]。随着果树育种技术的不断发展,新培育出的苹果栽培品种越来越多,保证品种的真实性、维护生产者与育种家的权益显得日趋重要。而苹果多用无性繁殖,树体基因型高度杂合,极易造成同物异名或同名异物现象,鉴别起来较为困难。以往对品种鉴别主要靠形态指标,但对于差异并不明显的个体,传统的形态特征很难识别,而利用分子标记(SSR )对品种进行鉴定和分类[8],是一种简单准确而且可靠的方法。因此构建苹果SSR指纹图谱数据库对苹果品种鉴别具有重要意义。
1 材料与方法
1.1 材料
供试苹果品种共40个(表1),均取自西北农林科技大学白水苹果试验站品种资源圃。于春季取新梢嫩叶保存在﹣80℃下备用。
表1 供试的苹果品种
Table 1 Apple cultivars used in this study
|
编号
No. |
品种
Variety |
亲本
Parent |
编号
No. |
品种
Variety |
亲本
Parent |
|
1 |
乔纳金Jonagold |
金冠×红玉GoldenDelicious×Jonathan |
21 |
华脆Huacui |
金冠×惠Golden Delicious×Megumi |
|
2 |
金冠Golden Delicious |
unknown |
22 |
华硕Huashuo |
美国八号×华冠American number eight×Huaguan |
|
3 |
澳洲青苹Granny Smith |
unknown |
23 |
千秋Senshu |
东光×富士Toko×Fuji |
|
4 |
秦阳Qinyang |
嘎啦实生Seeding of Gala |
24 |
夏艳Xiayan |
国光(新红星×红冠)Rall×(Starkrinson×Hongguan) |
|
5 |
国光Ralls |
unknown |
25 |
世界一Sekaiichi |
元帅×金冠Delicious×Golden Delicious |
|
6 |
珊夏Sansa |
嘎啦×茜Gala×Akane |
26 |
迎秋Yingqiu |
红玉×祝光Jonathan×Summer pearmain |
|
7 |
信浓红Xinnonghong |
津轻×贝拉Tsugaru×Bella |
27 |
锦红Jinhong |
红玉×鸡冠Jonathan×Jiguan |
|
8 |
松本锦Songbenjin |
unknown |
28 |
岱绿Dailv |
金冠实生Seeding of Golden Delicious |
|
9 |
东光Toko |
金冠×印度Golden Delicious×Indo |
29 |
卡米欧Cameo |
Red Delicious×Golden Delicious |
|
10 |
甘露Tallman's Sweet |
unknown |
30 |
红宝石Hongbaoshi |
国光×元帅Ralls×Delicious |
|
11 |
秦艳Qinyan |
天王红×秦冠Tianwanghong×Qinguan |
31 |
摩里士Mollie's Deli |
unknown |
|
12 |
君袖Northern Spy |
unknown |
32 |
泰山早霞TaishanZaoxia |
早捷实生 Seeding of Geneva Early |
|
13 |
华金Huajin |
unknown |
33 |
萌Kizashi |
嘎啦×富士Gala×Fuji |
|
14 |
金世纪Jinshiji |
嘎啦芽变Sport of Gala |
34 |
秋锦Qiujin |
国光×混合花粉Ralls×Pollen mixture |
|
15 |
甜黄魁Tianhuangkui |
祝光×黄魁Summer Pearmain×YellowTransparent |
35 |
倭锦Ben Davis |
unknown |
|
16 |
红盖露Honggailu |
嘎啦芽变Sport of Gala |
36 |
丹霞Danxia |
金冠实生Seeding of Golden Delicious |
|
17 |
北斗Hokudo |
富士×陆奥Fuji×Mutsu |
37 |
南方脆GS330 |
嘎啦×华丽Gala×Huali |
|
18 |
新红星Starkrinson |
红星芽变Spot of Red delicious |
38 |
秦星Qinxing |
新红星×秦冠Starkrinson×Qinguan |
|
19 |
陆奥Mutsu |
金冠×印度Golden Delicious×Indo |
39 |
早捷Geneva Early |
Quitd×七月红Quitd×Qiyuehong |
|
20 |
自由Liberty |
unknown |
40 |
红锦富Hongjinfu |
富士芽变Sport of Fuji |
1.2 方法
1.2.1 DNA提取
参考高华等方法,提取苹果叶片基因组DNA并采用琼脂糖凝胶电泳检测其质量,用紫外分光光度计ND-2000测定其质量浓度,最终将DNA样品稀释至80 mg·L-1备用。
1.2.2 引物合成
参考网站(http://www.hidras.unimi.it/)在上海生物工程有限公司合成144对普通SSR引物,将筛选的35对荧光引物5′端分别用FAM、HEX、TAMRA和ROX 4色荧光染料标记(表2),由上海生物工程有限公司合成。
1.2.3 PCR扩增
15µL的反应体积,含每种dNTP 0.20mmol/L,正向引物0.27mmol/L,反向引物0.27mmol/L,Taq DNA聚合酶1U,1×PCR缓冲液(不含Mg2+),MgCl2 1.5 mmol/L,样品DNA 6 ng/µL。
反应程序:94℃预变性4min,94℃变性45s,Tm℃(引物各异)复性45s,72℃延伸50s,35个循环,72℃延伸10min,4℃保存。
1.2.4变性聚丙烯酰胺凝胶电泳与荧光检测
PCR 扩增产物中加入6μL Loading buffer (98%甲酰氨,pH 8.0、10mmol/L EDTA,0.25%溴酚蓝,0.25%二甲苯青),95℃变性5min,冰上冷却,在6 %的变性聚丙烯酰胺凝胶上电泳50min 左右(80W 恒功率,不含预电泳30min) 。银染检测扩增产物。
将5'FAM荧光标记的PCR产物用超纯水稀释30倍,HEX荧光标记的PCR产物稀释15倍,TAMRA荧光标记的PCR产物稀释10倍,ROX荧光标记的PCR产物稀释5倍。分别取等体积的上述4种稀释后溶液混合,从混合液中吸取1 mL加入到DNA分析仪专用深孔板孔中。板中各孔各加入0.5mL LIZ500分子量内标和8.5mL去离子甲酰胺。除待测样品外,还应同时包括标准样品的扩增产物。将样品在PCR仪上95℃变性5min,立即取出置于冰上,冷却10 min以上。瞬时离心10 s后上机电泳。
1.2.5 电泳数据分析
使用Genemapper4.0软件收集原始数据,再利用Power Marker V3.25对供试材料进行分析。最后将两种方法获得的等位基因数据进行统计,对比与分析。
2 结果与分析
2.1 PCR扩增体系与引物退火温度
经优化,建立了适合苹果SSR引物PCR扩增体系(见方法3.2.3)与35对荧光引物的最佳退火温度(见表2)。
表2 筛选出的35对核心引物,荧光标记类型及最佳退火温度
Table 2 35 pairs of screened microsatellite primers, type of fluorescence and optimum annealing temperature
|
引物名称
Primer name
|
荧光
Fluorescence
|
退火温度Annealing
Temperature/℃ |
引物名称
Primer name
|
荧光
Fluorescence
|
退火温度Annealing
Temperature/℃ |
|
NZ02b1 |
5'FAM |
53 |
CH01f03b |
5'HEX |
56 |
|
CH03d07 |
5'FAM |
48 |
Hi12c02 |
5'TAMRA |
57 |
|
CH01d08 |
5'FAM |
53 |
CH04c10 |
5'TAMRA |
54 |
|
CH04e03 |
5'FAM |
54 |
CH05g03 |
5'TAMRA |
54 |
|
CH02d08 |
5'FAM |
57 |
CH04d08 |
5'TAMRA |
49 |
|
Hi02d04 |
5'FAM |
54 |
CH04g12 |
5'TAMRA |
54 |
|
Hi22f06 |
5'FAM |
55 |
CH02c02a |
5'TAMRA |
56 |
|
CH02c09 |
5'FAM |
55 |
CH04e02 |
5'TAMRA |
54 |
|
CH04f10 |
5'FAM |
50 |
CH04g07 |
5'TAMRA |
55 |
|
CH05d03 |
5'FAM |
55 |
CH05e06 |
5'TAMRA |
55 |
|
CH05c04 |
5'HEX |
53 |
CH05c07 |
5'ROX |
52 |
|
CH04a12 |
5'HEX |
53 |
CH02g09 |
5'ROX |
53 |
|
Hi04g05 |
5'HEX |
54 |
CH03d12 |
5'ROX |
53 |
|
CH01g05 |
5'HEX |
58 |
CH01f09 |
5'ROX |
54 |
|
Hi03c05 |
5'HEX |
53 |
Hi03d06 |
5'ROX |
53 |
|
Hi03eo3 |
5'HEX |
56 |
CH04d02 |
5'ROX |
56 |
|
CH01f07a |
5'HEX |
56 |
Hi02c07 |
5'ROX |
56 |
|
CH04e05 |
5'HEX |
54 |
|
|
|
2.2 核心引物的筛选及SSR多态性
选用均匀分布在苹果17条染色体上的144对SSR引物,利用8份苹果材料进行PCR扩增及电泳检测,并对PCR扩增体系与引物退火温度进行优化,筛选出35对多态性高、谱带清晰的引物,然后这35对引物对40份材料扩增,分别进行6%变性聚丙烯酰胺凝胶电泳检测与SSR荧光标记毛细管电泳检测,对数据进行统计分析后得到40份材料在35个位点的数据(表2)35对引物共检测到314个等位位点,每对SSR引物扩增出等位位点数3~15个,平均8.97个;多态性信息含量指数 (PIC) 变化范围为0.4553~0.8346,平均为0.6920;各个位点的杂合度在0.4750~1.0000之间,平均为0.7943;标记系数 (MI) 平均为6.2080 ,其中CH04c10引物对苹果基因组DNA变异检测最有效,其多态性信息含量指数和标记指数均最高,分别为0.8346和12.5190。在所选35对引物中PIC>0.5的高度多态性信息引物33对,0.25<PIC<0.5的中度多态性信息引物2对 (CH01f09, 0.4622; Hi03e03, 0.4553)。
表 3 35个SSR位点在40个苹果品种上检测到的遗传多样性
Table 3 Genetic diversity of 40 cultivars revealed by 35 SSR primers
|
标记Marker |
主等位基因频率
Major Allele Frequency |
基因型数
Genotype No. |
等位基因数Allele No. |
基因多样性
Gene Diversity |
杂合度
Heterozygosity |
多态性信息含量
PIC |
标记系数
MI |
|
CH01d08 |
0.3375 |
9 |
5 |
0.7459 |
0.9500 |
0.7017 |
3.5083 |
|
Hi04g05 |
0.3250 |
18 |
9 |
0.7959 |
0.8000 |
0.7697 |
6.9274 |
|
CH04g12 |
0.3158 |
17 |
12 |
0.7822 |
0.9737 |
0.7533 |
9.0398 |
|
Hi03d06 |
0.5946 |
13 |
8 |
0.6019 |
0.5946 |
0.5694 |
4.5556 |
|
CH02d08 |
0.3500 |
20 |
12 |
0.8000 |
0.7750 |
0.7769 |
9.3224 |
|
Hi03c05 |
0.2750 |
20 |
11 |
0.8269 |
0.9500 |
0.8056 |
8.8621 |
|
CH01f09 |
0.6125 |
6 |
5 |
0.5322 |
0.6750 |
0.4622 |
2.3109 |
|
Hi02d04 |
0.2500 |
17 |
11 |
0.8403 |
1.0000 |
0.8210 |
9.0306 |
|
Hi03e03 |
0.7125 |
10 |
9 |
0.4741 |
0.4750 |
0.4553 |
4.0980 |
|
CH05g03 |
0.4000 |
12 |
10 |
0.6819 |
0.9750 |
0.6288 |
6.2884 |
|
CH03d12 |
0.4875 |
12 |
10 |
0.6775 |
0.6500 |
0.6339 |
6.3385 |
|
NZ02b1 |
0.3590 |
11 |
7 |
0.7094 |
0.8462 |
0.6562 |
4.5932 |
|
CH05c04 |
0.3000 |
16 |
10 |
0.7984 |
0.9750 |
0.7711 |
7.7112 |
|
Hi12c02 |
0.4103 |
9 |
6 |
0.6769 |
0.5897 |
0.6179 |
3.7076 |
|
CH05c07 |
0.4079 |
15 |
11 |
0.7687 |
0.8947 |
0.7446 |
8.1906 |
|
CH03d07 |
0.3625 |
18 |
10 |
0.7663 |
0.7250 |
0.7332 |
7.3316 |
|
CH04a12 |
0.4189 |
15 |
10 |
0.7684 |
0.8108 |
0.7464 |
7.4640 |
|
CH04c10 |
0.2564 |
21 |
15 |
0.8498 |
0.6154 |
0.8346 |
12.5190 |
|
CH02g09 |
0.3784 |
12 |
7 |
0.7359 |
0.8108 |
0.6951 |
4.8654 |
|
CH04e03 |
0.4474 |
16 |
10 |
0.7029 |
0.6842 |
0.6618 |
6.6180 |
|
CH01g05 |
0.3750 |
12 |
8 |
0.7341 |
0.8250 |
0.6909 |
5.5271 |
|
CH04d08 |
0.2125 |
20 |
9 |
0.8388 |
0.8250 |
0.8184 |
7.3656 |
|
Hi22f06 |
0.5375 |
6 |
3 |
0.5816 |
0.7250 |
0.5032 |
1.5095 |
|
CH01f07a |
0.3000 |
16 |
9 |
0.8078 |
0.8500 |
0.7825 |
7.0422 |
|
CH02c02a |
0.2895 |
24 |
14 |
0.8380 |
0.7895 |
0.8210 |
11.4935 |
|
CH04d02 |
0.4625 |
7 |
5 |
0.7022 |
0.9250 |
0.6619 |
3.3094 |
|
CH02c09 |
0.3000 |
14 |
8 |
0.7872 |
0.9000 |
0.7559 |
6.0469 |
|
CH04e05 |
0.5769 |
11 |
9 |
0.6203 |
0.6667 |
0.5881 |
5.2928 |
|
CH04e02 |
0.4875 |
11 |
7 |
0.6853 |
0.7000 |
0.6449 |
4.5141 |
|
Hi02c07 |
0.4125 |
10 |
7 |
0.6753 |
1.0000 |
0.6187 |
4.3311 |
|
CH04f10 |
0.2750 |
19 |
11 |
0.7978 |
0.8500 |
0.7684 |
8.4528 |
|
CH04g07 |
0.5000 |
12 |
10 |
0.7022 |
0.8158 |
0.6768 |
6.7681 |
|
CH05d03 |
0.4375 |
15 |
9 |
0.7216 |
0.6750 |
0.6855 |
6.1695 |
|
CH01f03b |
0.3375 |
15 |
9 |
0.7716 |
0.8000 |
0.7390 |
6.6512 |
|
CH05e06 |
0.5526 |
10 |
8 |
0.6524 |
0.6842 |
0.6253 |
5.0022 |
|
平均
Mean |
0.4016 |
14 |
9 |
0.7272 |
0.7943 |
0.6920 |
6.2080 |
2.3 指纹图谱分析
采用以上35对引物对40个苹果主栽品种进行指纹图谱分析,35对引物都只能将40个苹果品种分为几个类型,但无任何一个引物可以完全区分40个品种。引物CH03d07在品种1、3、4、6、9、20、24、33、34、35、36和37上具有特异性条带可以与其它品种区分开来,而品种2、11、31、39 带型相同;品种5、8、18、22、26、27、28和40带型相同;品种7、10、15和16带型相同;品种12、13、19、21、25和29带型相同;品种14和32带型相同;品种17、23、30和38带型相同。而继续从35对引物中挑选多态性相对丰富的引物进行组合即可完全鉴定40个品种,如CH03d07,NZ02b1和CH05c04即可将40主栽品种完全区分开。
2.4 多重毛细管电泳检测与变性聚丙烯酰胺凝胶电泳检测对比(综合运用两种方法)
为了检验6%变性聚丙烯酰胺凝胶电泳检测方法的可靠性,用荧光标记毛细管电泳检测方法对40个试验材料在35对SSR引物所构建的指纹数据进行了验证。结果两种方法检测到的等位基因数目和各实验材料对应的等位基因类型基本一致(图1和图2),只有少数引物在少数品种上荧光标记毛细管电泳检测比变性聚丙烯酰胺凝胶电泳检测多出1个等位基因(图1和图3)。
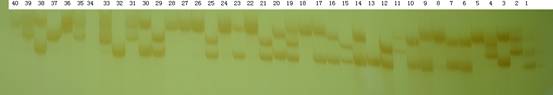
图 1 引物CH03d07对40份苹果主栽品种的扩增结果
1~40.品种编号同表3
Figure 1 DNA fragments amplified by SSR primer CH03d07 in 40 persimmon major cultivars
1~40.The codes of varieties are same as Table 3
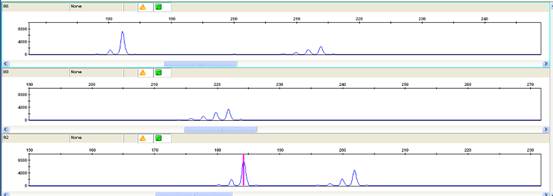
图 2 荧光引物CH03d07在16号,8号和12号(从上至下)苹果品种上的毛细管电泳峰型
Figure 2 Capillary electrophoresis profiless of the sixteenth, eighth and twelfth apple materials(From up to down) at fluorescent primer CH03d07
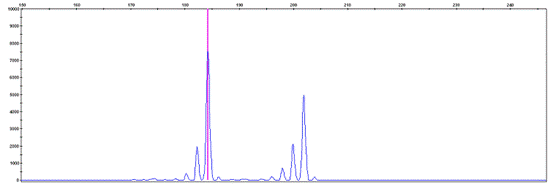
图 3 荧光引物CH03d07在13号苹果品种上的毛细管电泳峰型
Figure 3 Capillary electrophoresis profiless of the thirteenth apple material at fluorescent primer CH03d07
3 结论与讨论
从研究苹果指纹图谱PCR扩增体系的优化过程可知SSR对反应体系要求非常严格,尤其是对苹果这种高度杂合的物种,在反应体系中引物,引物、Mg2+两种成分含量变化对扩增条带影响较大[1,10],引物、Mg2+浓度增加均会导致大量非特异性条带的出现,而基于SSR方法所建立的指纹图谱要求所扩增的条带稳定性与特异性高,因此对PCR反应体系的优化是完成指纹图谱建立的前提。本研究通过大量实验探索出一套稳定适用于苹果SSR扩增的体系与程序,为后续工作的进行奠定了基础。
选择合适的引物是构建苹果分子指纹图谱的另一重要前提[14-15],本研究选取的144对SSR引物均匀位于苹果17对染色体上。在对144对SSR引物进行多次筛选的基础上,筛选出35对多态性高、重复性好的引物进行图谱构建。从数据分析中发现,不同的引物对品种间多态性的鉴别能力有较大差异,无任何一个引物可以完全区分40个品种。而将35个核心引物分别进行合理的3~4对引物组合后发现,每个组合可以将所有供试材料区分开,因此通过不同引物的有限组合,可以大大提高引物的鉴别能力。而随着品种数量的进一步增加,引物的组合基数便要进一步加大,而世界上的苹果栽培品种有几千种,对于所有的苹果主栽品种或出现新品种时,难免会出现同一引物在不同品种间出现相同谱带的现象,此时应采用不同的核心引物组合或者筛选新的SSR引物将其区分开,以补充和扩展现已建立的初步指纹图谱。
在采用SSR聚丙烯酰胺凝胶电泳检测方法构建苹果品种DNA数据库的工作中,如何准确地整合不同批次、不同胶块的苹果品种DNA指纹鉴定数据一直是个难题[17]。为了保证苹果品种DNA指纹图谱方法的可行性与结果的可靠性,本研究采用了6%变性聚丙烯酰胺凝胶电泳检测方法与SSR标记毛细管电泳检测方法相结合进行验证,与常规的凝胶电泳检测方法相比,荧光标记毛细管电泳检测数据更为精确,同时很好地解决了大规模不同批次DNA指纹鉴定数据有效整合和准确比较的问题。而且多重毛细管电泳不仅可以成倍提高检测效率,而且还可以显著降低检测成本。本研究结果证明两种方法检测到的等位基因数目和各实验材料对应的等位基因类型基本一致。
参考文献 :
[1] Luis G, Cristina M, Oliveira. Molecular characterization of cultivars of apple (Malus domestica Borkh.) using microsatellite(SSR and ISSR) markers [J]. Euphytica, 2001, 122:81-89.
[2] Tautz D. Hyper variability of simple sequences as a generalsource for polymorphic DNA markers [J]. Nuleic AcidsRes, 1989, 17(16):6463-6471.
[3] Takezak I N, Nei M. Genetic distances and reconstruction of phylogenetic trees from microsatellite DNA [J]. Genetics, 1996, 144:389-399.
[4] Liebhard R, Gianfranceschi L, Koller B, Ryder C D, Tarchini R, Van De, Weg E. And Gessler C. Development and characterisation of 140 new microsatellites in apple (Malus×domestica Borkh.). Molecular Breeding, 2002, 10:217-241.
[5] 高 华. 苹果栽培品种的DNA指纹图谱构建及遗传多样性分析 [D]. 杨凌:西北农林科技大学. 2010.
[6] 高 源, 刘凤之, 曹玉芬, 等. 苹果属种质资源亲缘关系的SSR分析 [J]. 果树学报, 2007, 24(2):129-134.
[7] 王爱德, 李天忠, 许雪峰, 等. 苹果品种的SSR 分析 [J]. 园艺学报, 2005, 32(5):875-877.
[8] Guiford P, Prakash S, Zhu J M. Microsatellites in Malus domestica(apple): abundance, polymorphism and cultivar identi- fication [J]. Theor Appl Genet, 1997, 94:249-254.
[9] 高 源, 王 昆, 田路明, 曹玉芬, 等. 应用TP-M13-SSR 技术鉴定苹果品种 [J].果树学报, 2010, 27(5):833-837.
[10] 蔡 青, 姜立杰. 苹果主栽品种的SSR分子标记鉴别 [J]. 中国农学通报, 2007, 129-134.
[11] 高 源, 王 昆, 田路明, 等. TP-M13-SSR技术及其在苹果种质资源遗传多样性研究中的应用 [J]. 植物遗传资源学报, 2011, 12( 2):228-233.
[12] 王凤格, 赵久然, 郭景伦.中国玉米新品种DNA库建立系列研究:I. 玉米品种纯度及真伪鉴定中SSR标准实验体系的建立 [J]. 玉米科学, 2003, 11(1):3-6.
[13] 郝晨阳, 王兰芬, 贾继增. SSR标记和银染技术的比较分析 [J]. 作物学报, 2005, 31(2):144-149.
[14] 陈 琛, 张兴桃, 程 斐.秋甘蓝品种的SSR指纹图谱的构建 [J]. 园艺学报, 2011, 38(1):159–164.
[15] 艾呈祥, 秦志华, 陶吉寒, 等. 32个柿主栽品种SSR构建及遗传变异分析 [J]. 西北植物学报, 2011, 31(11):2185-2191.
[16] 王壮伟, 赵 密. 38个欧美草莓栽培品种SSR指纹图谱的构建 [J]. 果树学报, 2011, 28(6): 1032-1037.
[17] 程本义, 夏俊辉, 龚俊义, 杨仕华. 记毛细管电泳检测法在水稻DNA鉴定中的应用 [J]. 中国水稻科学, 2011, 25(6):672-676.
作者简介:王立新(1987-),男,河北邯郸人,硕士研究生,研究方向为果树育种与生物技术。
通讯作者:高华(1970-),男,陕西延安人,副研究员,硕士,主要从事苹果新品种选育、配套栽培技术研究及示范推广工作;赵政阳(1964-),男,陕西渭南人,教授,博士,主要从事常规育种、分子生物学育种等。

